
A Anvisa determinou, nesta quarta-feira (21/6), a apreensão e a proibição da comercialização, da distribuição e do uso de unidades falsificadas dos medicamentos Botox®️ (Lote: C3709C3) e Durateston® (Lote: 701012LR). A medida foi publicada por meio da Resolução RE 2.198/2023.
Já nesta quinta-feira (22/6), por meio da Resolução-RE 2.208/2023, também foram determinadas a apreensão e a proibição da comercialização, da distribuição e do uso de unidades falsificadas do lote W07209 do produto Dysport®️.
Os produtos podem ser diferenciados pelas datas de fabricação e validade, que são diferentes dos produtos originais. Veja um resumo das diferenças na tabela e saiba mais detalhes abaixo.
|
Produto |
Número do lote |
Datas do produto original |
Datas do produto falsificado |
|
Botox®️ |
C3709C3 |
Fabricação: 09/2014 Validade: 08/2017 |
Fabricação: 05/2022 Validade: 05/2025 |
|
Dysport®️ |
W07209 |
Fabricação: 01/2022 Validade: 12/2023 |
Fabricação: 01/2023 Validade: 12/2024 |
|
Durateston® |
701012LR |
Fabricação: 01/2021 Validade: 01/2023 |
Fabricação: 06/2022 Validade: 06/2024 |
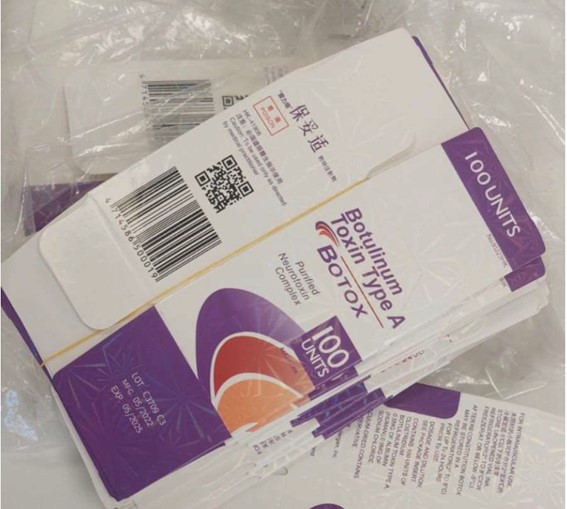
Falsificação do Botox – lote C3709C3
As medidas foram tomadas após operação policial que encontrou embalagens do Botox®️ falsificadas.
A data de fabricação do lote original (C3709C3) é 09/2014 e a data de validade 08/2017. O produto falsificado traz o mesmo número de lote, mas a sua data de fabricação consta como 05/2022 e a de validade como 05/2025, conforme imagem abaixo.
Além disso, o lote original (C3709C3) não foi destinado ao mercado brasileiro, tratando-se, portanto, de falsificação. O medicamento Botox®️ está devidamente registrado em nome da empresa Allergan Produtos Farmacêuticos.
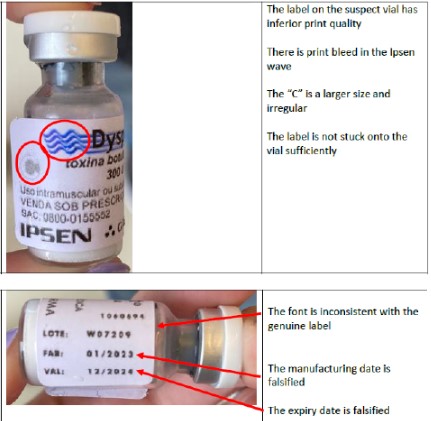
Falsificação do Dysport 300U (toxina botulínica A) – lote W07209
As medidas foram tomadas após a comunicação da empresa detentora do registro do medicamento, a Beaufour Ipsen Farmacêutica, à Anvisa.
A empresa esclarece que o lote W07209 do produto Dysport®️ 300U original foi importado em abril de 2022, com data de fabricação em 01/2022 e prazo de validade até 12/2023. Já o produto falsificado apresenta como data de fabricação 01/2023 e como data de validade 12/2024.
A empresa também descreveu diversas diferenças existentes entre o produto original e o falsificado. Foram verificadas discrepâncias no tipo de frasco, na qualidade de impressão do rótulo e no volume de produto no frasco, conforme fotos abaixo.
É importante esclarecer que o produto Dysport®️ 300 U, lote W07209, fabricado em janeiro de 2022 e com prazo de validade em dezembro de 2023, é verdadeiro e não há qualquer problema relacionado à qualidade, à eficácia e à segurança do produto, que pode estar disponível no mercado.
Falsificação do Durateston® – lote 701012LR
As medidas foram tomadas após a Anvisa ser informada pela empresa Aspen Pharma Indústria Farmacêutica Ltda. sobre a circulação, no mercado brasileiro, de unidades falsificadas do medicamento.
O número 701012LR corresponde a um número de lote original de Durateston®, fabricado em 01/2021 e válido até 01/2023. No entanto, as unidades falsificadas possuem data de fabricação e de validade divergentes (fabricação em 06/2022 e validade até 06/2024), conforme foto abaixo.

Embalagem do medicamento falsificado
Orientações gerais à população e aos profissionais de saúde
A Anvisa orienta que a população e os profissionais de saúde somente adquiram medicamentos em estabelecimentos devidamente regularizados, sempre na embalagem completa (dentro da caixa) e mediante emissão da nota fiscal.
Em caso de identificação de unidades dos medicamentos com suspeita de falsificação, a população ou os profissionais de saúde não devem utilizar o produto e devem entrar em contato com as empresas detentoras do registro desses produtos, para verificar sua autenticidade.
Além disso, o fato deve ser comunicado imediatamente à Anvisa, preferencialmente por meio do sistema Notivisa (no caso de profissional de saúde) ou por meio do sistema da Ouvidoria, utilizando a plataforma FalaBR (no caso de pacientes).